百济神州:针对初治慢淋3期研究数据积极 百亿CLL赛道百悦泽冲击一线疗法
摘要: 7月30日,百济神州(06160)宣布一项重磅进展,BTK抑制剂泽布替尼最新公布了一项全球性3期试验的积极结果,全球3期临床研究SEQUOIA的期中分析达到主要终点,
7 月 30 日,百济神州(06160)宣布一项重磅进展,BTK抑制剂泽布替尼最新公布了一项全球性3期试验的积极结果,全球3期临床研究SEQUOIA的期中分析达到主要终点,意味着百悦泽在慢淋一线治疗中的优势得到证明,这对于百悦泽在全球市场的拓展将有重要意义。
数据显示,相比化学免疫治疗,百悦泽 显着延长了初治的慢性淋巴细胞白血病(CLL)患者的无进展生存期,并展示了良好的安全性与耐受性。
SEQUOIA是继全球3期头对头ALPINE研究后,百悦泽 第二项在CLL中取得积极结果的全球性3期试验,更是百悦泽 冲击CLL一线治疗,证实其治疗地位的重要一役。SEQUOIA是一项随机、多中心、全球性的3期试验(NCT03336333),入组患者超过580例,旨在评价百悦泽 与苯达莫司汀联合利妥昔单抗(B+R)用于治疗初治CLL或小淋巴细胞淋巴瘤(SLL)患者的有效性和安全性。该试验由三个队列组成,而此次期中分析,对比了百悦泽 与B+R,用于治疗未显示17p13.1染色体缺失(del[17p])的初治CLL或SLL患者的数据。
中位随访时间为25.8个月时,百悦泽 相较B+R在无进展生存期(PFS)方面显示出具有高度统计学显着性的改善,因此SEQUOIA试验达到其主要终点,即基于独立审查委员会(IRC)评估结果确定的PFS。
此外,SEQUOIA试验表明,作为一项次要终点,基于研究者评估的PFS也显示了具有统计学显着性的改善。同时,百悦泽 的耐受性总体良好,与其已知的安全性特征一致。
对此,百济神州血液学首席医学官黄蔚娟博士表示:“综合三项全球性临床研究SEQUOIA、ALPINE、205试验和AU-003试验的数据,证实了我们对百悦泽 的信心,我们相信它能够改善数十万CLL患者的治疗结果。我们很欣慰地在SEQUOIA试验的期中分析中看到,百悦泽 显着延长了初治CLL患者的无进展生存期,同时其显示的安全性特征与其在全球开发项目中观察到的特征一致,迄今为止,已有超过2300例患者接受了百悦泽 治疗。”
百悦泽 是一款由百济神州科学家自主研发的BTK小分子抑制剂,目前正在全球进行广泛的临床试验项目,作为单药和与其他疗法进行联合用药治疗多种 B 细胞恶性肿瘤。由于新的BTK会在人体内不断合成,百悦泽 的设计通过优化生物利用度、半衰期和选择性,实现对BTK蛋白完全、持久的抑制。凭借与其他获批BTK抑制剂存在差异化的药代动力学,百悦泽 能在多个疾病相关组织中抑制恶性B细胞增殖。
目前,百悦泽 已在美国、中国、阿联酋、加拿大、以色列等国家或地区中获批多项适应症,并先后在全球针对8项适应症开展了近30项临床试验。目前,共有30多项百悦泽 针对多项适应症的相关上市申请完成递交工作,覆盖欧盟以及其他20多个国家或地区。在中国,百悦泽 已经被纳入国家医保目录,并于2021年3月1日生效,以更亲民的价格,惠及我国本土患者。
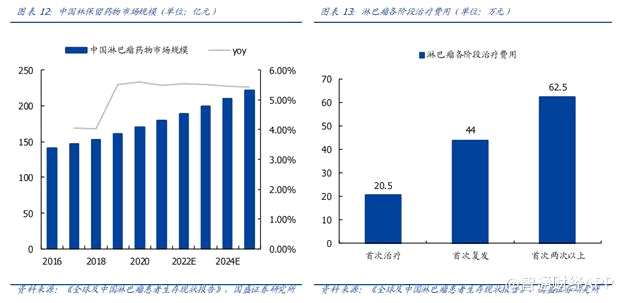
慢性淋巴细胞白血病(CLL)是成人中最常见的一种白血病,在2017年,全球约有114000例新发的CLL病例。根据国家癌症中心公布的数据,目前我国淋巴瘤预计发病率约为 6.89/10 万;据世界卫生组织统计,淋巴瘤全球发病率年增长率为 7.5%,是目前发病率增长最快的恶性肿瘤之一,全球每年约有 35 万新发病例。国盛证券认为中国淋巴瘤市场将在五年内突破 200 亿元。
市场竞争方面,截至目前,全球共仅有 5 款 BTK 抑制剂获批上市,竞争状况良好。目前全球上市的产品分别为艾伯维和强生的伊布替尼、阿斯利康的阿卡替尼、百济神州的泽布替尼、吉利德和小野制药的 tirabrutinib,以及诺诚健华的奥布替尼,其中伊布替尼、泽布替尼和奥布替尼已经在中国获批上市。
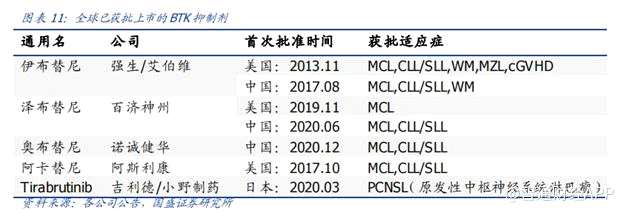
其中百济神州的泽布替尼在中国和美国两地获批上市,并且两地上市时间间隔不到一年,用时远小于强生/艾伯维的伊布替尼,也证明百济神州强大的研发实力。
作为一家全方位一体化的全球生物科技公司,截至2021年5月,百济神州商业化产品及临床阶段候选药物共有 47 款,包括 8 款商业化阶段药物、4 款已申报候选药物和 35 款临床阶段候选药物,如 TIGIT单抗,OX40,Bcl-2,HPK,TIM-3等。
值得一提的是,据公司发布的一季度公司发布的业绩来看,百济神州首次实现盈利,数据显示,2021 年Q1公司实现总收入 6.06亿美元,相较去年同期 0.521 亿美元大幅提升;归母净利润 0.67 亿美元,去年同期亏损 3.64 亿美元。伴随着公司更多产品管线落地,公司的盈利能力也会逐渐显现出来。
CLL,神州